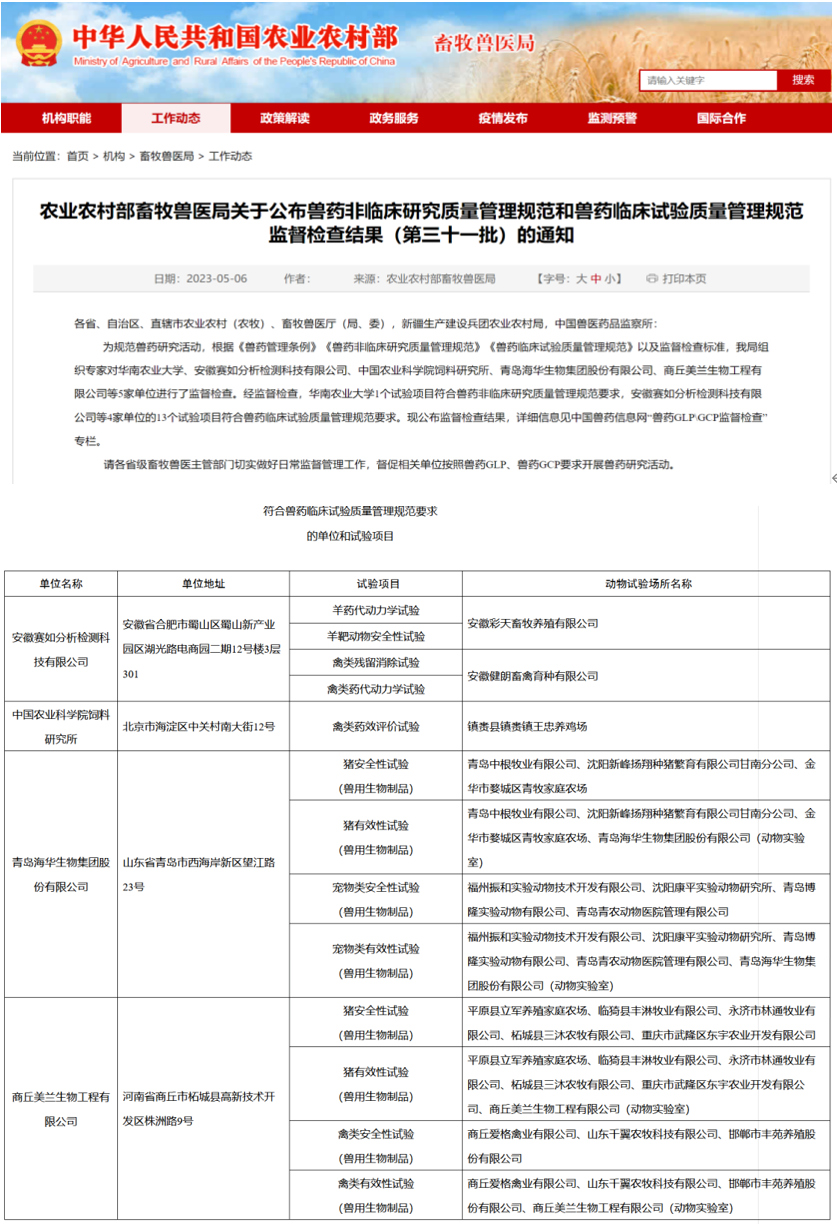
兽药企业如何开展兽药临床研究
近年来我国兽用化学药品行业市场规模呈现上升的态势,兽用化学药物的研究开发是兽药产业的中心主题之一。对于兽药企业而言,如何正确开展新兽药临床研究,是值得关注的问题。
一、兽药临床试验开展需要具备哪些条件?
兽药临床研究的前提,需要先完成新兽药临床前研究。兽用化药临床前研究的项目,包括生产工艺、结构确证、理化性质及纯度,剂型选择、处方筛选,检验方法、质量指标,稳定性,药理学、毒理学等。
申请新兽药注册,应当进行临床试验。兽药临床研究的实施,需要委托通过农业农村部GCP资质认证的兽药临床试验机构完成。
二、兽药临床试验开展有哪些基本流程?
兽药临床研究的基本流程大致如下:
(1)申请人与兽药临床试验机构沟通,确定试验项目及费用。
(2)申请人提供临床研究前研究资料(主要包括立题目的与依据、兽药质量标准草案、药效学及药理毒理研究资料等)、试验用兽药(包括受试兽药和对照兽药)及检测报告。
(3)申请人与兽药临床试验机构沟通,共同确定试验方案。
(4)申请人向临床试验场所(包括动物试验场所)所在地省级畜牧兽医行政管理部门提交开展临床试验的备案材料。
(4)兽药临床试验机构开展临床试验、撰写报告。
三、兽用化药临床研究涉及的试验有哪些?
兽用化学药品临床研究,一般包括I期临床(主要指药代动力学试验、靶动物安全性试验)、II期临床试验、III期临床试验。申请注册用于食用动物的兽药,还应当进行残留消除试验、仿制药应进行生物等效性试验。具体需根据化药类型选择所需的临床试验类型。
(1)药代动力学试验:其目的是通过研究药物在靶动物体内的吸收、分布、代谢和排泄的规律,对药物在动物体内随时间变化而发生的量变规律进行测定,获取新兽药在靶动物的药动学参数。
(2)靶动物安全性试验:其目的是了解畜禽对受试药物推荐剂量、多倍剂量和延长用药时间使用时的临床反应、组织病理学和生理生化指标变化的特征;从而为明确受试药物的不良反应和临床应用时的注意事项提供依据。
(3)Ⅱ期临床试验:其目的是初步评价兽药对靶动物目标适应症的防治作用和安全性,确定合理的给药剂量方案。此阶段的研究设计可以根据具体的研究目的,采用人工发病模型或自然病例,进行随机对照临床试验。
(4)Ⅲ期临床试验:其目的是进一步验证兽药对靶动物目标适应症的防治作用和安全性,评价利益与风险关系,最终为兽药注册申请获得批准提供充分的依据。试验应为具有足够样本量的随机盲法对照试验。
(5)生物等效性试验:评价仿制药的质量试验,是利用生物利用度研究的方法,以药代动力学参数为指标,比较同一种药物的相同或者不同剂型、在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异。
(6)残留消除试验:其目的是通过食用动物用药物残留消除试验获取受试药物在可食性组织中是否产生残留,并为制定合理的休药期提供理论和实践依据。
四、影响兽药临床研究有哪些因素?
(1)前期研究资料的提供:申请人往往不能提供一套完整的前期研究资料,致使兽药临床试验机构对受试兽药的功能、主治不好定位,难以确定试验方案,也无法保证获得满意的试验结果。
(2)试验用兽药的提供:试验用兽药包括受试兽药和对照兽药。受试兽药应为“中试产品”;生产批号与第三方检测报告上的批号不一致;说明书与前期研究的给药途径、剂量等不符;有效期短于试验期限。对照兽药应为“已上市产品”,在剂型、性状上与受试兽药差异较大,造成设盲过程繁琐。(3)试验方案的制定:造模方法选择不当或造模剂量过低,难以造出目标病证,造模剂量过高使动物死亡率过高,难以评价兽药的疗效;病例的诊断标准、纳入标准、剔除标准的制定不合理,实际试验中无法操作,或主观条件偏大,易造成的误判。
(4)试验过程的质量控制:研究者未能严格遵循试验方案,在试验各环节缺少可行的质量控制措施,在动物入选、原始记录、参数检验等方面未能按照SOP执行,导致试验结果的规范性、可靠性存在问题。五、兽用化药临床研究一般要花多长时间?
不同类型的兽药临床试验,试验周期不尽相同。一般在3-6个月。
安徽赛如作为安徽省唯一一家兽药GCP试验机构,建立了完善的管理制度和标准操作规程,现已获得羊、禽类的药代动力学、残留消除试验、靶动物安全性试验资质,根据客户需求制定详细的试验计划和试验方案,欢迎咨询!
参考文献:
【1】新兽药研制管理办法,农业农村部令2019年第2号修改。
【2】行业专家对话录。